
Acidità e pH
Che cosa sono gli acidi? Cosa significa esattamente pH? Qual è la sua importanza nei prodotti alimentari? Lo spieghiamo in questo articolo, cercando di semplificare il più possibile i concetti
- Introduzione
- Diversi tipi di acidi
- Come si misura
- Diversi tipi di acidi
- Importanza tecnologica: esempi
Introduzione
Fin dall’antichità l’uomo ha imparato a riconoscere il gusto acido, percepito in bocca quando, ad esempio, si consumano prodotti come yogurt, succo di limone o aceto. La parola acido deriva proprio dal latino acetum, ossia aceto, ma il suo significato è esteso a tutte le sostanze che a livello gustativo trasmettono la stessa sensazione “pungente”. Il gusto acido è dovuto a diverse sostanze che chimicamente si comportano in modo simile e vengono pertanto raggruppate in un’unica famiglia: gli acidi, appunto. La caratteristica che li accomuna è la capacità di rilasciare ioni idrogeno quando sono disciolti in acqua. Tali ioni vengono indicati come H+, dove “H” è il simbolo chimico dell’idrogeno mentre il “+” segnala la presenza di una carica positiva dovuta alla perdita di un elettrone (il quale ha carica negativa). Fu il chimico svedese Svante August Arrhenius, nella seconda metà dell’Ottocento, a osservare tale comportamento e a elaborare per la prima volta la definizione di:
Acido sostanza che sciolta in acqua si dissocia e libera ioni idrogeno, con carica positiva (H+).
Ad esempio: acido cloridrico (noto come “acido muriatico”)
HCl –> H+ + Cl–
Base sostanza che sciolta in acqua si dissocia e libera ioni ossidrile (detti anche idrossidi), con carica negativa (OH–).
Ad esempio: idrossido di sodio (“soda caustica”)
NaOH –> Na+ + OH–
In realtà è stata successivamente elaborata una definizione più precisa di acidi e basi, ma non è il caso di addentrarci troppo nel complesso mondo della chimica. Limitiamoci a un assaggio necessario e sufficiente a comprendere l’argomento e a padroneggiare meglio ingredienti e processi di trasformazione.
Diversi tipi di acidi
La tendenza a dissociarsi e liberare ioni H+ è più o meno spinta a seconda del tipo di acido. Gli acidi che in soluzione sono completamente dissociati si definiscono “forti” (ad esempio l’acido cloridrico), mentre quelli che hanno una minore tendenza a dissociarsi, per cui solo una piccola percentuale sarà in forma dissociata, sono detti “deboli” (acido acetico, acido ascorbico). La capacità di un acido di dissociarsi è espressa attraverso la costante di dissociazione (Ka), un numero fisso che non dipende dalla concentrazione dell’acido nella soluzione ma solo dalle sue caratteristiche chimiche, le quali fanno sì che lo ione idrogeno venga ceduto più o meno facilmente. Minore è la costante di dissociazione e meno si dissocia l’acido. Esistono acidi poliprotici che possono rilasciare più di uno ione idrogeno. Un esempio è l’acido carbonico H2CO3: tende a dissociarsi liberando uno ione H+ e uno ione HCO3–, comunemente chiamato bicarbonato. È lo stesso che va a costituire il bicarbonato di sodio che tutti conosciamo (NaHCO3). In determinate condizioni, l’acido carbonico libera entrambi gli ioni H+ e ciò che resta è lo ione carbonato, che ha 2 cariche negative (CO32-).
Come si misura
Risale alla metà del 1600 la messa a punto del primo metodo per misurare l’acidità di una soluzione. L’autore, il chimico irlandese Robert Boyle, scoprì che lasciando cadere una goccia di soluzione su un pezzo di carta impregnato di succo di viola (ricco di antociani, molecole appartenenti alla famiglia dei flavonoidi) il colore da bluastro diventava rosso con soluzioni acide e verde con soluzioni basiche, mentre in caso di soluzioni neutre rimaneva blu. Lo stesso principio è alla base del funzionamento delle cartine al tornasole, strisce di carta impregnate di una miscela di coloranti estratti dai licheni, in grado di virare il proprio colore a seconda dell’acidità della soluzione con cui entra in contatto. Per confronto con una scala cromatica si deduce quanto la soluzione è acida o basica.

Il concetto di pH venne introdotto in epoca relativamente più recente, nel 1909, a opera del biochimico danese Søren Peter Lauritz Sørensen. Misurando l’acidità mediante potenziometria (con elettrodi) lo scienziato ritenne più comodo esprimere i valori di concentrazione degli ioni H+ in forma logaritmica e propose questa nuova grandezza, che chiamò pH dal latino pondus hidrogenii, potenziale dell’idrogeno.
Per chi è a digiuno di matematica: il logaritmo di un numero “b” è l’esponente “c” da dare a una base “a” per ottenere lo stesso numero “b”.
Logab = c (si legge: logaritmo in base a di b = c) significa che b=ac
Se non viene indicato alcun numero alla base del logaritmo, per convenzione si intende che è in base 10. Ad esempio: log1.000 = 3, poiché 103 (10 alla terza) = 1.000
Il pH non è altro che il logaritmo negativo della concentrazione di ioni H+ nella soluzione:
pH = -log[H+]
Per esempio, pH 4 significa che la concentrazione di ioni H+ è 10-4 moli/litro (M, unità di misura che si usa in chimica), ossia 1/10.000 = 0,0001 M.
La relazione tra pH e concentrazione di ioni H+, quindi, è inversamente proporzionale: minore è il pH e maggiore sarà la concentrazione di ioni H+, quindi più acida risulterà la soluzione.
Il pH può variare da 0 a 14. Le soluzioni con pH inferiore a 7 sono acide, mentre quelle con pH superiore a 7 sono basiche. pH 7 indica la neutralità.
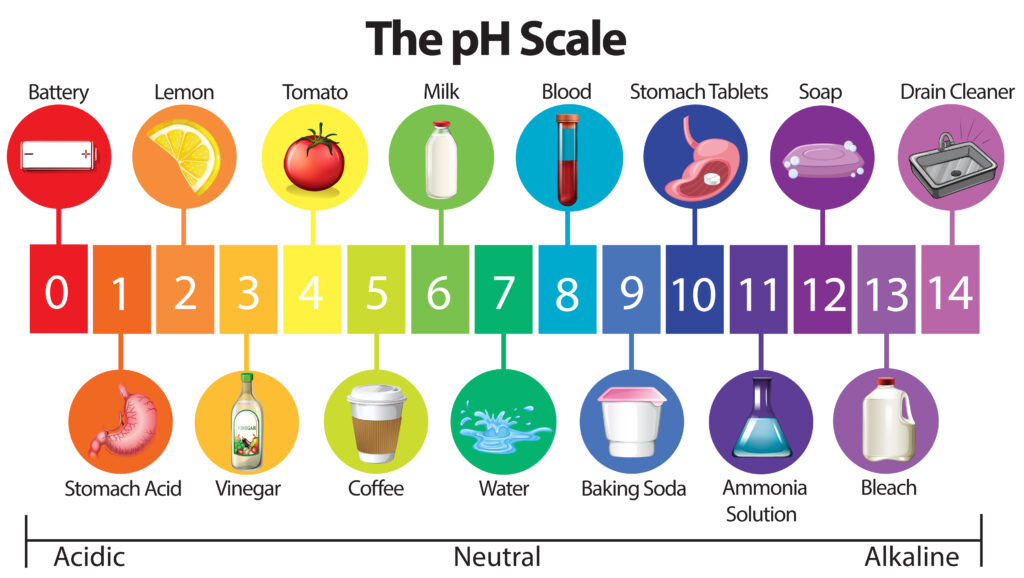
Per misurare il pH in modo più accurato rispetto alle cartine al tornasole si utilizza un apposito strumento, chiamato piaccametro (o pHmetro), che misura la quantità di ioni idrogeno mediante una sonda (elettrodo a vetro) immersa nella soluzione. L’elettrodo misura la differenza di potenziale elettrico tra i due lati di una membrana situata alla sua estremità. Tale differenza di potenziale è dovuta alla differenza di concentrazione di ioni idrogeno tra la soluzione che si sta analizzando e l’interno dell’elettrodo. Il suo utilizzo è piuttosto semplice, anche se richiede l’accortezza di eseguire regolarmente le calibrazioni con soluzioni tampone. Mentre nei prodotti liquidi il pH può essere misurato direttamente, quelli solidi in genere necessitano di essere preventivamente frullati insieme ad acqua distillata (che ha pH neutro). Esistono anche piaccametri dotati di elettrodi che possono essere inseriti direttamente in campioni solidi o semisolidi tal quali.

La percezione in bocca
Salvo pochissime eccezioni, come l’albume d’uovo che ha pH di circa 9, tutti gli alimenti hanno pH più o meno acido. Quello del latte è vicino alla neutralità (pH 6,7), mentre nello yogurt è di 4,0-4,6 perché il processo di fermentazione ha trasformato lo zucchero lattosio in acido lattico. Nel limone il pH è 2 per via della presenza di acido citrico, mentre altra frutta ha pH più alto: mediamente 3,5 in pesche e albicocche, 4 nei mandarini, 5 nelle banane e 6,5 nei meloni. Ma come fanno i cibi acidi a trasmettere il tipico gusto pungente? Una volta introdotti nella cavità orale si mescolano con la saliva, e gli acidi organici presenti raggiungono i recettori contenuti nelle membrane delle cellule gustative che tappezzano la lingua (sono raggruppate nei bottoni gustativi, a loro volta riuniti in papille, piccole protuberanze visibili anche a occhio nudo). I recettori del gusto acido sono canali che permettono il passaggio degli acidi organici all’interno della cellula, dove si liberano ioni idrogeno innescando una serie di segnali chimici che portano alla stimolazione delle fibre nervose preposte alla trasmissione del segnale al cervello per l’elaborazione. Anche i recettori del gusto salato sono canali ionici, però specifici per ioni sodio e, in minor misura, potassio. I recettori del gusto dolce, amaro e umami, invece, appartengono a una classe differente, quella dei GPCR (G Protein Coupled Receptors = recettori accoppiati a proteine G), che funzionano legando le molecole anziché permettendone il passaggio all’interno della cellula. Tornando al gusto acido: se è solamente dovuto alla liberazione di ioni H+, allora perché il limone sa di limone e lo yogurt di yogurt? Perché oltre al senso del gusto, quando mangiamo viene stimolato anche l’olfatto, che si basa su un meccanismo differente, con diverse tipologie di recettori (situati nella cavità nasale) che rilevano le molecole volatili, odorose.
Importanza tecnologica: esempi
Tenere sotto controllo il pH è una delle strategie per inibire la crescita microbica. La maggioranza dei microrganismi patogeni e alterativi cresce a valori di pH che vanno da 4,6 a 8. Il valore di pH 4,6 è preso come spartiacque tra alimenti che supportano e non supportano la crescita di patogeni perché a valori inferiori il Clostridium botulinum, temibile batterio anaerobio, non cresce né produce tossine. Per questo motivo l’acidificazione è tra i sistemi più antichi per conservare i cibi. Si può ottenere aggiungendo ad esempio aceto (nel caso delle conserve sott’aceto) o succo di limone, oppure additivi quali acido acetico (E260), acido citrico (E330) e altri acidi organici, generalmente indicati in etichetta come “correttori di acidità”.
Anche le fermentazioni sono impiegate dall’uomo fin dalla notte dei tempi per conservare i cibi, e anche qui c’entra l’acidificazione. I processi fermentativi sono attuati da microrganismi che utilizzano le molecole degli alimenti per crescere: le trasformano per ottenere energia rilasciando come residui molecole più semplici quali acido lattico, acetico, propionico e altri acidi organici, anidride carbonica, etanolo. È solo grazie alle fermentazioni se esistono prodotti come yogurt, birra, vino e aceto, e prodotti da forno ottenuti con lievito di birra o pasta madre.
Nel caso dei prodotti da forno con lievito madre il controllo del pH è essenziale per assicurarsi che la maturazione del lievito e lo sviluppo dell’impasto procedano correttamente. I valori di pH ottimali per il lievito naturale di grano tenero variano da 3,8 (dopo un periodo di stazionamento a 4°C o alla fine di un riposo notturno) a 4,3 (lievito maturo pronto per essere usato come inoculo o agente lievitante). Come abbiamo visto, si può misurare abbastanza facilmente con un piaccametro. Questo strumento, però, dice solo quanti ioni H+ sono presenti, senza dare informazioni sugli acidi da cui provengono, che sono principalmente il lattico e l’acetico. Nella gestione del lievito madre è utile conoscere la concentrazione di questi due acidi e le proporzioni con cui sono presenti perché sono un indice di corretto equilibrio tra i microrganismi (batteri lattici, acetici e lieviti) e influiscono sulle caratteristiche sensoriali dei prodotti finiti. Normalmente in un lievito naturale di farina di grano tenero è auspicabile che la presenza di acido lattico sia attorno al 70-75% sul totale degli acidi. Per misurare le concentrazioni di acido lattico e acido acetico è necessario ricorrere a opportune analisi chimiche di laboratorio.
Un altro esempio di situazione in cui conoscere il pH è essenziale per non avere brutte sorprese sul risultato è l’impiego di pectina. Questo termine indica una famiglia di molecole formate da tante unità di acido galatturonico, in cui la funzione acida può essere modificata in gruppo metossile. Sul mercato si distinguono pectine ad alto metossile (HM=high methoxyl), con più del 50% (di solito 55-75%) delle unità di acido galatturonico contenenti gruppi metossile, e pectine a basso metossile (LM=low methoxyl), con meno del 50% (di solito 20-40%) di unità di acido galatturonico metossilate. Se il grado di metossilazione è inferiore al 10% si parla di acido pectico o pectato. La distinzione è importante perché cambia la funzione tecnologica. Per gelificare, le pectine HM necessitano di una cospicua quantità di zucchero (almeno il 55%) e di un pH intorno a 2,5 in modo che la maggior parte dei gruppi acidi della pectina sia in forma non dissociata, perciò in grado di instaurare legami chiamati ponti idrogeno e interazioni idrofobiche e formare così la tipica struttura tridimensionale. Le pectine LM riescono invece a formare gel a diversi valori di pH e con un contenuto di zucchero inferiore, però richiedono ioni calcio (o altri ioni con 2 cariche positive) per far sì che le catene di pectina (cariche negativamente) si attraggano fra loro.
Bibliografia
– Guarnieri V., Il gusto del pH, Science Magazine n. 17, marzo 2017, Pearson Italia
– Montanari G, Omnia fermenta – tecnologia degli impasti a lievito madre, 2020, Chiriotti Editori
– Public Health England (2017). Determination of pH in Food and Water Samples. National Infection Service. Food, Water & Environmental Microbiology Standard Method FNES63 [P2]; Version 2.
Articolo pubblicato sul n.347 della rivista Pasticceria Internazionale (Chiriotti Editori)

Cioccolato: questione di cristallizzazione
Potrebbe anche piacerti

Funzioni tecnologiche delle fibre alimentari
17 Luglio 2020
Bioplastiche: facciamo chiarezza
25 Agosto 2020